新的膳食成分(NDIs): NDI通知内容、程序和快速参考指南
FDA的膳食补充剂的意图:新膳食成分的通知和相关问题:指导行业是帮助制造商和分销商的膳食补充成分和确定上市前的安全通知必须提交给该机构的产品包含或者被认为是一个新的膳食成分(NDI)。这样的上市前的安全通知经常被称为NDI通知。
在第一本由三部分组成的系列文章的关于新膳食成分,膳食成分的定义以及总结NDI指导。此外,一些常见问题关于NDI通知要求解决。回顾历史的通知要求对某些预期的NDIs使用传统的食物,以及考虑NDI通知提交,在第二篇文章概述了。第三,NDI系列的最后一篇文章将提供NDI通知过程的概述,以及总结的信息包含在一个NDI通知。此外,决策树为NDI通知(图1),因为它出现在FDA的指导行业,可以在本文中找到。
在一个NDI通知
作为一个高级的摘要,NDI通知应包括:
- 身份信息NDI和膳食补充剂;
- 安全使用或其他证据,和
- 总结的基础安全的结论。
建议大纲的具体信息包括表1中可以找到一个NDI通知。
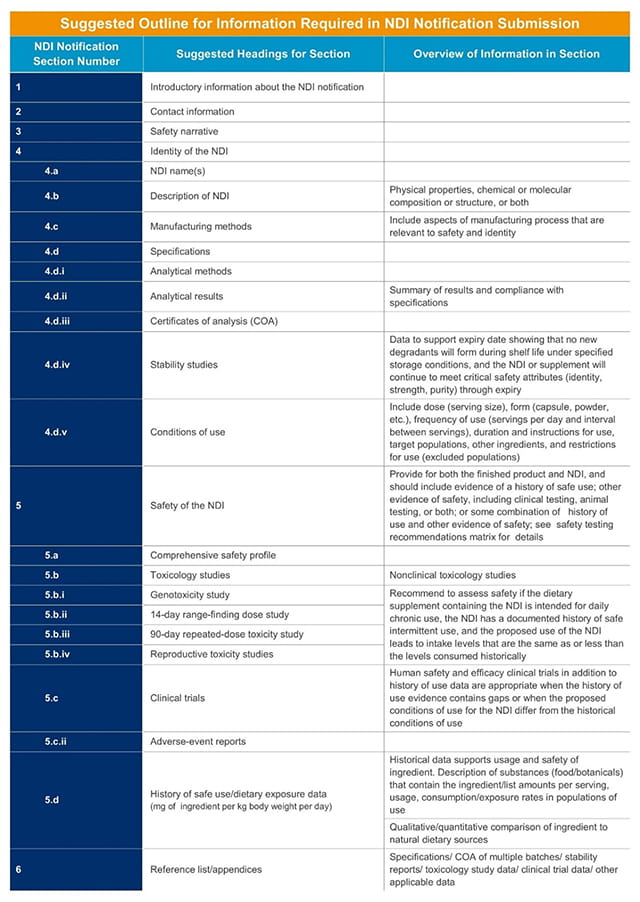
表1。建议大纲所需的信息包含在新的膳食成分(NDI)向FDA提交通知
身份信息在一个NDI通知:常见问题
当准备提交一个NDI通知FDA,类型的标识信息应该包括什么?
FDA建议包括以下信息关于新身份的膳食成分:
- 新的膳食成分的名称,其贸易名称(如果不同),和任何其他名字NDI的;
- NDI的物理性质的描述,包括化学的描述或分子新膳食成分的组成或结构,或两者兼而有之;
- 控制为批次的变化和/或可以接受的范围,当适用;
- 的身份和水平中任何可能出现的杂质和污染物,而NDI或膳食补充剂;
- 任何附加信息特定于类型的膳食成分,包括维生素、矿物质、氨基酸、成分、代谢产物,和其他离散实体、盐、酶的共价修饰衍生品膳食成分混合物,植物,提取和集中,成分在发酵过程中产生,和活微生物成分
- 身份的描述其他膳食成分和其他成分的膳食补充剂。
美国食品和药物管理局还建议建立身份规范新的膳食成分和组件的利尿和补充,适用于建立膳食补充剂的安全的基础。详细描述身份规格表的形式,如指导V.I.A.节所示5日,还应该包括在通知。
制造的NDIs,生产过程应该被描述,任何制造过程适用于安全的细节和利尿的身份应该彻底的记录。
生产的NDIs,多少细节应该包括在制造过程的描述?
了解整个流程用于制造新的膳食成分和膳食补充剂产品对FDA评估至关重要。然而,详细描述生产只能限于过程相关的安全和身份NDI,如果这些过程可以隔离和标识。
规范是什么?
FDA指导行业的规范定义为一组标准,由制造商或分销商的材料。在这种情况下,这将是NDI的制造商或经销商或膳食补充剂。该规范包括标准:
- 每个组件的材料,
- 材料作为一个整体。
NDI通知,规范应包括关键的安全属性,可以省略属性不相关的安全或身份的新饮食成分。规范表应该包括以下几点:
- 测试的列表;
- 验收标准为每个测试,
- 验收标准的分析方法用于支持。
验收标准被定义为数值限制,范围,或其他标准所描述的测试。决定接受或拒绝被分析的成分或产品是根据验收标准。因此,验收标准应该是具体的,而不是模糊的或模棱两可的。
分析方法是至关重要的,因为他们支持验收标准。分析方法的描述在一个NDI通知应包括详细的指令集是精确的结果被接受为目的。分析方法描述应该包括:
- 所有的步骤,从准备测试样品报告的结果分析;
- 一个完整的描述分析方法(无论它是专有的或包含出版),和
- 该方法的详细信息(例如,色谱柱的描述,溶剂洗脱条件,任何参考标准)的来源和真实性。
必须提供所有这些信息,因为它提供了理解的基础是至关重要的一个方法是用来识别感兴趣的分析物。
规范流程和材料应该被包括在一个NDI通知吗?
补充规范中包含的组件必须建立分销商和制造商的膳食补充剂,每21 CFR 111.70 (b)。组件规范的要求包括:
- 每个组件的身份物种形成;
- 组件规范必须确保纯度规格,力量,和膳食补充剂生产使用组件的组成,和
- 限制类型的掺杂,污染可能或可能导致成品的掺假。
NDI通知应该提供一个规范的详细描述在表形式如下指导V.I.A.5节。
如果膳食补充剂产品包含多种成分混合而成,额外的标识信息应提交什么?
身份和水平中每个成分的膳食补充剂应该NDI通知中详细说明,包括饮食和其他成分用于技术或功能的影响(如粘结剂、填料、添加剂和颜色)。此外,应该包括在NDI通知如下:
- 描述如何安全使用的成分组合与历史或其他证据的安全的膳食补充剂NDI将礼物,和
- 声明解决配方成分的生物利用度,包括使用任何粘结剂或填料影响生物利用度的膳食成分的补充。
哪些信息应该包括如果NDI或膳食补充剂将包括一个到期或“使用”标签上的日期呢?
如果NDI或膳食补充剂含有过期或使用“日期包装,数据应该包括在NDI通知来演示:
- 没有新的降解将形成在标签中指定的储存条件下保质期NDI通知
- NDI或补充将继续满足关键身份的安全属性,力量,和纯度通过标记到期或“使用”的日期。
历史上的安全使用或其他证据NDI通知:常见问题
需要什么样的安全信息来支持一个NDI通知?
一个NDI通知必须包含的信息形式的基础的结论将会包含一个新的膳食补充剂膳食成分合理预期的安全标记的条件下使用,每21事项350 b (a) (2)。通常,这包括:
- 一个适当的安全使用的历史;
- 安全性研究;或
- 两者都有。
应该安全使用和安全的历史测试数据提交一个NDI吗?
这取决于使用的历史证据就足以支持一个NDI补充的安全。应该被包括在一个NDI通知如下:
- 安全使用的历史的证据;
- 其他证据的安全,包括临床试验、动物试验,或两者,或
- 历史的某种组合使用和其他安全的证据。
安全测试的建议不同,依赖于记录,历史使用的新饮食成分以及提出使用利尿。表2说明了FDA的建议NDI通知安全测试矩阵格式的建议。

表2。安全测试建议矩阵新的膳食成分(NDI)通知提交
我怎么确定历史使用“每日慢性”或“间歇”?
每日长期使用是指摄入至少一天一次,每一天,连续至少三个月,包括长期使用。对于一个NDI通知的目的,间歇使用被认为是低于日常长期使用,可以每天和有限的时间,或者non-daily和一生的时间。
哪些因素有助于确定是否提交动物或人类安全性研究除了使用的历史数据?
FDA的膳食补充剂:新膳食成分的通知和相关问题:指导工业国家最好的方法来确定使用的历史数据提供了充分依据合理的期望,膳食补充剂含有一个NDI将安全是比较使用NDI通知中提出的条件与安全使用的记录历史条件。下面的例子被该机构的指导情况FDA通常建议补充使用的历史数据与其他动物或人类安全性研究:
- 提出更高的每份摄入量或每日总摄入量;
- 再提出消费比历史上报道的时间(例如,通知指出,NDI将销售标签建议或暗示连续日常使用改善消化功能,但安全使用的历史只涉及很少,短期用于消化不良);
- 不同路线的政府提出(例如,关于历史数据的使用一种物质作为湿敷药物或注射通常将不足以支持的安全NDI用于膳食补充剂,通过定义适用于摄入);
- 改变从历史使用可能会增加潜在的毒性作用(例如,NDI将出售作为地面叶的胶囊,但使用的形式在历史上是一个茶制成的植物的根),和/或
- 目标人群的变化(例如,成人安全使用已经建立的历史,但NDI将用于膳食补充剂销售供儿童使用)。
有哪些来源的安全测试协议,可以用于测试的NDIs和膳食补充剂吗?
有用的指南安全测试包括:
- 经济合作与发展组织(OECD)指导测试的化学物质,第四节:健康的影响;
- 协调测试指南,化学品安全与污染防治办公室发表的美国环境保护署(EPA);和
- 风险评估的原则和方法中的化学物质的食物,共同发表的联合国粮食及农业组织(粮农组织)和世界卫生组织(世卫组织)。
总结的基础结论NDI的安全通知:常见问题
一个NDI通知应包括独立的安全概要NDI和将使用NDI的膳食补充剂产品?
是的。FDA建议两个安全配置文件中使用的讨论使用的历史和其他证据的安全:
- 第一个安全概要文件应该包括一个全面的安全性评估的安全新膳食成分,和
- 第二应该包含一个膳食补充剂的叙述解释为什么通知中的信息提供了基础的结论,推荐或建议的条件下使用时详细的产品标签,包含NDI合理预计的补充剂是安全的。
应该被包括在一个全面的安全性NDI吗?
NDI安全概要文件应该包含所有可用的客观总结人类和动物毒理学资料,包括发表和未发表的安全性研究,以及任何其他相关信息NDI安全评估。这包括:
- 历史使用的抗利尿;
- 摄入水平,频率和持续时间的历史使用;
- 人口的规模和特征的描述,利尿;
- 定量和定性的比较与抗利尿成分进行安全性研究引用;
- 可接受的每日摄入量(ADI)抗利尿和解释它是如何计算
- 的安全边际NDI的基础和安全边际是如何计算的。
如果NDI综合安全概要文件包含商业秘密或机密的商业信息,这些信息应在提交相应的识别。
NDI资源
NDI监管指导能承受得起。图1提供了一个快速参考NDI决策树来帮助你确定你的膳食成分符合要求NDI通知。
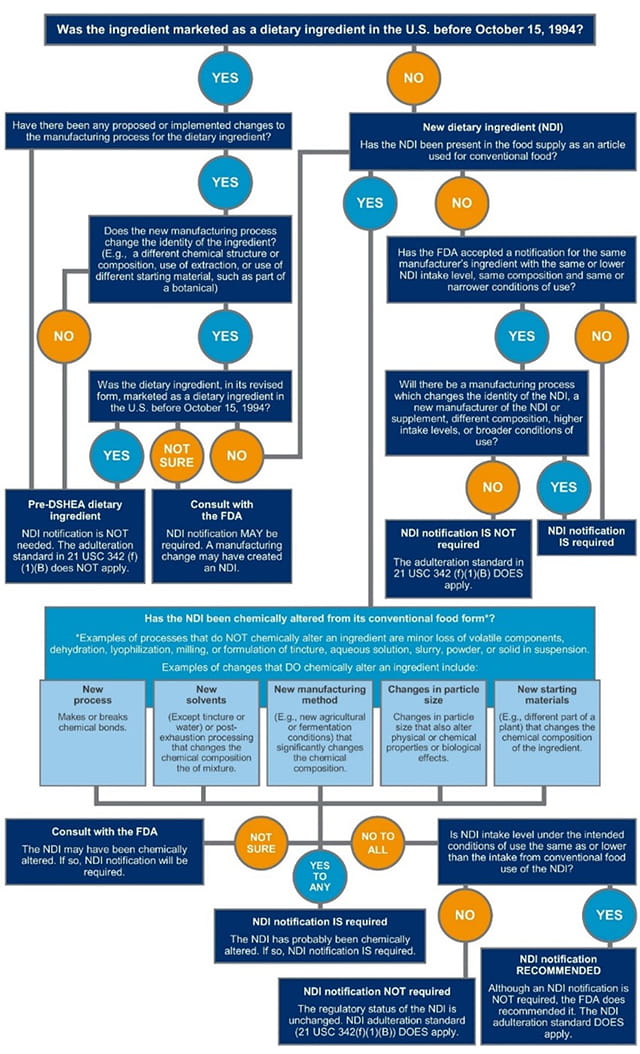
图1所示。决策树新膳食成分(NDI)通知
导航NDI法规和必需的数据
FDA-registered,经验丰富的合同研究组织(CRO)和/或合同开发和生产组织(CDMO)可以帮助膳食补充剂制造商和分销商导航监管要求和规定。万博官网app体育元素的科学家们几十年的经验制定的咨询团队、分析和推进膳食补充剂产品,都有良好的记录支持成功的监管意见。
找到相关的app1manbetx客户端






